Цитозоль

Цитозо́ль (англ. cytosol, происходит от греч. κύτος — клетка и англ. sol от лат. solutio — раствор) — жидкое содержимое клетки. Большую часть цитозоля занимает внутриклеточная жидкость. Цитозоль разбивается на компартменты при помощи разнообразных мембран. У эукариот цитозоль располагается под плазматической мембраной и является частью цитоплазмы, в которую, помимо цитозоля, входят митохондрии, пластиды и другие органеллы, но не содержащаяся в них жидкость и внутренние структуры. Таким образом, цитозоль представляет собой жидкий матрикс, окружающий органеллы. У прокариот большая часть химических реакций метаболизма происходит в цитозоле, и лишь небольшая их часть происходит в мембранах и периплазматическом пространстве. У эукариот, хотя многие реакции протекают в органеллах, некоторые реакции, например, гликолиз или синтез жирных кислот, происходят в цитозоле.
Химически цитозоль представляет собой сложную смесь веществ, растворённых в жидкости. Хотя большая часть цитозоля представлена водой, его структура и свойства внутри клеток изучены недостаточно. Концентрации ионов, таких как катионы калия и натрия, различаются в цитозоле и внеклеточной жидкости. Эта разница концентраций существенна для таких процессов, как осморегуляция, передача сигнала и генерация потенциала действия в возбудимых клетках, таких как эндокринные, нервные и мышечные клетки. В цитозоле также содержится много макромолекул, которые могут изменять поведение молекул посредством эффекта скученности макромолекул (англ. Macromolecular crowding).
Хотя ранее цитозоль рассматривали как простой раствор молекул, он имеет несколько уровней организации. В их числе градиенты концентраций ионов (например, кальция), крупные ферментативные комплексы, которые взаимодействуют друг с другом и осуществляют разнообразные химические реакции, а также белковые комплексы вроде карбоксисом и протеасом, которые заключают в себе часть цитозоля.
Определение
[править | править код]Термин «цитозоль» был предложен в 1965 году Генри Ларди (англ. Henry A. Lardy) и первоначально использовался в отношении жидкости, которая выходит из повреждённых клеток и при ультрацентрифугировании[2][3] которой оседают нерастворимые компоненты. Растворимые клеточные экстракты не идентичны растворимой части цитоплазмы и обычно называются цитоплазматической фракцией[4].
В настоящее время термин «цитозоль» используется для обозначения жидкой фракции цитоплазмы живой (интактной) клетки[4]. В состав цитозоля не входят жидкости, находящиеся внутри органелл[5]. Чтобы избежать путаницы в употреблении термина «цитозоль» в отношении жидкой части цитоплазмы и экстрактов клеток, для обозначения жидкой части цитоплазмы живых клеток иногда используется термин «водянистая цитоплазма» (англ. aqueous cytoplasm)[3].
Свойства и состав
[править | править код]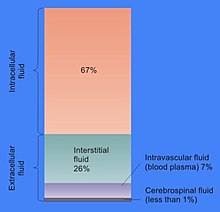
Доля объёма клетки, приходящаяся на цитозоль, варьируется: в то время как у бактерий цитозоль обеспечивает сохранение структуры клетки и занимает почти весь её объём, у растений большая часть объёма клетки приходится на крупную центральную вакуоль[6]. Цитозоль состоит, главным образом, из воды, растворённых ионов, малых молекул и крупных водорастворимых молекул (например, белков). Большая часть небелковых молекул цитозоля имеет массу до 300 Да[7]. Цитозоль включает колоссальное количество метаболитов: например, у растений в клетках должно производиться до 200 000 метаболитов[8], а в одной дрожжевой клетке или клетке бактерии Escherichia coli должно образовываться около тысячи молекул[9][10].
Вода
[править | править код]Большую часть объёма цитозоля составляет вода (около 70 % в типичной клетке)[11]. рН внутриклеточной жидкости составляет 7,4[12], при этом у человека рН цитозоля составляет от 7,0 до 7,4 и имеет большее значение в случае растущих клеток[13]. Вязкость цитоплазмы примерно такая же, как у воды, хотя скорость диффузии малых молекул через эту жидкость примерно в 4 раза меньше, чем в чистой воде, из-за столкновений с многочисленными макромолекулами[14]. На примере рачков-артемий было показано, как вода влияет на клеточные функции. Показано, что сокращение доли воды в клетке на 20 % останавливает метаболизм, причём при высыхании клетки скорость метаболизма прогрессирующе падает, и всякая метаболическая активность прекращается, когда уровень воды в клетке падает на 70 % ниже нормы[3].
Хотя вода необходима для жизни, структура этой воды в цитозоле изучена слабо, так как методы вроде ядерного магнитного резонанса и спектроскопии дают только лишь общую информацию о структуре воды, не учитывая микроскопические вариации. Даже структура чистой воды понятна плохо из-за склонности воды образовывать водяные кластеры посредством водородных связей[15].
Классическое представление о воде в клетке таково, что около 5 % воды находится в связанном с другими веществами состоянии (то есть обеспечивает сольватацию), а остальная вода имеет такую же структуру, как чистая вода[3]. Сольватирующая вода неактивна при осмосе и может иметь другие свойства как растворитель, концентрируя одни молекулы и выталкивая другие[16]. Согласно другой точке зрения, на весь цитозоль огромное влияние оказывает большое количество растворённых макромолекул, и поведение цитозольной воды сильно отличается от поведения чистой воды[17]. Есть предположение, что внутри клетки имеются участки большей или меньшей плотности воды, которые могут оказывать сильное влияние на структуру и функции других частей клетки[15][18]. Однако результаты ядерного магнитного резонанса противоречат этому предположению, так как, согласно этим результатам, 85 % воды клетки ведёт себя как чистая вода, а остальная вода находится в связанном с макромолекулами состоянии и менее подвижна[19].
Ионы
[править | править код]Концентрации ионов в цитозоле коренным образом отличаются от таковых во внеклеточной жидкости, кроме того, в цитозоле содержится больше заряженных молекул, таких как белки и нуклеиновые кислоты. В таблице ниже рассматриваются концентрации ключевых ионов в воде и во внеклеточной жидкости[англ.].
| Ион | Концентрация в цитозоле (мМ) | Концентрация в крови (мМ) |
|---|---|---|
| Калий | 139 | 4 |
| Натрий | 12 | 145 |
| Хлор | 4 | 116 |
| Бикарбонат | 12 | 29 |
| Аминокислоты в белках | 138 | 9 |
| Магний | 0,8 | 1,5 |
| Кальций | < 0,0002 | 1,8 |
В отличие от внеклеточной жидкости, цитозоль имеет большую концентрацию ионов калия и меньшую концентрацию ионов натрия[20]. Это различие в концентрации ионов необходимо для осморегуляции. Если бы концентрации ионов внутри клетки и вне её были одинаковы, по законам осмоса вода бы непрерывно поступала в клетку из-за того, что клетка содержит больше макромолекул, чем их имеется снаружи. Ионы натрия выкачиваются из клетки, а ионы калия, напротив, закачиваются ферментом Na+/K±АТФ-азой. Далее ионы калия движутся по градиенту концентрации наружу через калиевые каналы, и выход катионов вызывает отрицательный мембранный потенциал. Чтобы сбалансировать разницу в потенциалах, из клетки также выходят отрицательно заряженные ионы хлора через специальные хлоридные каналы. Утрата ионов натрия и хлора компенсирует осмотический эффект высокой концентрации макромолекул внутри клетки[20].
Клетки могут выдерживать ещё большую разницу в потенциалах, накапливая в цитозоле осмопротекторы[англ.], такие как трегалоза и бетаины[20]. Некоторые из этих молекул помогают клетке выжить при полном высушивании и вхождении в криптобиоз[21]. В этом состоянии цитозоль и осмопротекторы превращаются в стеклоподобное твёрдое вещество, которое предохраняет клеточные белки и мембраны от повреждений при высыхании[22].
Благодаря низкой концентрации кальция в цитоплазме он может работать как вторичный посредник в кальциевых путях передачи сигнала[англ.]. В этом случае сигнал, такой как молекула гормона или потенциал действия, открывает кальциевые каналы, по которым кальций устремляется в цитозоль[23]. Увеличение концентрации кальция в цитозоле активирует другие сигнальные молекулы, такие как кальмодулин и протеинкиназа C[24]. Другие ионы, такие как ионы хлора и калия, тоже могут выполнять сигнальные роли в цитозоле, но эта роль в настоящее время плохо изучена[25].
Макромолекулы
[править | править код]Белковые молекулы, которые не прикреплены к мембранам или цитоскелету, растворены в цитозоле. Количество белков в клетках чрезвычайно велико и приближается к 200 мг/мл, белки занимают от 20 до 30 % всей клетки[26]. Однако измерение точного количества белка в цитозоле интактной клетки очень сложно, поскольку некоторые белки слабо связаны с мембранами или органеллами и выходят в раствор при лизисе клеток[3]. Действительно, эксперименты, в которых плазматическая мембрана клетки аккуратно разрушалась под действием сапонина без повреждения других мембран, показали, что наружу выходит четверть белков. Такие полуразрушенные клетки были способны, тем не менее, синтезировать белки, если в доступе есть АТФ и аминокислоты, поэтому многие белки цитозоля в действительности связаны с цитоскелетом[27]. Однако идея о том, что большинство белков прочно связаны с сетью, называемой микротрабекулярная решётка (англ. microtrabecular lattice), в настоящее время представляется маловероятной[28].
У прокариот геном содержится в цитозоле в виде структуры, называемой нуклеоидом[29]. Нуклеоид представляет собой неупорядоченную массу ДНК и ассоциированных белков, которые контролируют репликацию и транскрипцию бактериальной хромосомы и плазмид. У эукариот геном заключён в ядре, который отделён от цитозоля ядерными порами, не допускающими свободного прохождения молекул диаметром более 10 нм[30].
Высокая концентрация молекул в цитозоле порождает эффект, известный как макромолекулярное уплотнение, при котором эффективная концентрация молекул повышается, поскольку у них нет места для свободного движения. Этот эффект может вызывать существенные изменения в скорости химической реакции и положении равновесия[26]. Его действие на изменение констант диссоциации особенно важно, поскольку благодаря этому благоприятной становится ассоциация макромолекул, например, сборка белков в мультибелковый комплекс и связывание ДНК-связывающих белков со своей мишенью на молекуле ДНК[31].
Организация
[править | править код]Хотя компоненты цитозоля не отделены друг от друга мембранами, они не смешиваются друг с другом случайным образом, и внутри цитозоля имеется несколько уровней организации, локализующих молекулы в специальных сайтах цитозоля[32].
Градиенты концентрации
[править | править код]Хотя мелкие молекулы быстро диффундируют в цитозоле, внутри цитозоля могут поддерживаться специальные градиенты концентрации. Хорошим примером могут служить «кальциевые вспышки» (англ. calcium sparks), которые появляются на короткий период времени в участке рядом с открытым кальциевым каналом[33]. «Вспышки» достигают около 2 мкм в диаметре и длятся всего несколько миллисекунд, хотя некоторые вспышки могут сливаться с образованием более крупных градиентов — «кальциевых волн» (англ. calcium waves)[34]. Градиенты концентрации других малых молекул, таких как кислород и АТФ, могут образовываться вблизи кластеров митохондрий, но механизм их образования менее понятен[35][36].
Белковые комплексы
[править | править код]Белки могут ассоциировать друг с другом с образованием белковых комплексов, которые часто содержат набор белков с похожими функциями, например, набор ферментов, катализирующих разные этапы одного и того же метаболического пути[37]. Благодаря этому формируются субстратные каналы (англ. Substrate channeling), при которых продукты реакции одного фермента передаются непосредственно следующему ферменту пути без высвобождения в раствор[38]. Субстратные каналы могут сделать метаболический путь более быстрым и эффективным, чем если бы ферменты располагались в цитозоле случайным образом, и предотвращают выход в раствор нестабильных промежуточных продуктов пути[39]. Хотя в большом количестве метаболических путей ферменты плотно связаны друг с другом, существуют и более слабо связанные ферментные комплексы, которые очень трудно изучать вне клетки. Поэтому и значимость этих комплексов для метаболизма остаётся неясной[40][41].
Белковые компартменты
[править | править код]
Некоторые белковые комплексы содержат внутри полость, изолированную от цитозоля. Примером такого комплекса может служить протеасома[42]. Набор субъединиц протеасомы формирует полый «бочонок», содержащий протеазы, разрушающие цитоплазматические белки. Присутствие в цитоплазме неправильно уложенных белков небезопасно, поэтому «бочонок» покрыт регуляторными белками, которые распознают белки с меткой о деградации (убиквитиновой меткой) и направляют их в протеасому для разрушения[43].
Другой класс белковых компартментов — бактериальные микрокомпартменты[англ.], которые состоят из белковой оболочки, заключающей в себе разнообразные ферменты[44]. Обычно такие компартменты имеют размер 100—200 нм и состоят из плотно подогнанных друг к другу белков[45]. Хорошо изученным примером микрокомпартмента может служить карбоксисома, которая содержит ферменты фиксации углерода (например, рубиско)[46].
Цитоскелетное сито
[править | править код]Хотя цитоскелет не является частью цитозоля, присутствие этой сети филаментов ограничивает диффузию крупных частиц внутри клетки. Например, в нескольких экспериментах контрольные частицы размером около 25 нм (почти как рибосома[47]) удалялись из частей цитозоля, расположенных вблизи границы клетки и клеточного ядра[48][49]. Такие компартменты могут содержать более густую сеть из актиновых филаментов, чем остальной цитозоль. Эти микродомены могут влиять на расположение крупных частиц вроде рибосомы и других органелл, концентрируя их в одних местах клетки и вытесняя из других[50].
Функции
[править | править код]У цитозоля нет какой-то одной функции, потому что в нём протекает множество процессов. Среди этих процессов передача сигнала от клеточной мембраны к местам внутри клетки, таким как клеточное ядро[51] и разные органеллы[52]. В цитозоле также происходят многие реакции цитокинеза после распада ядерной оболочки в митозе[53]. Другая значительная роль цитозоля — транспорт метаболитов от мест образования к местам использования. Среди метаболитов относительно простые водорастворимые молекулы, такие как аминокислоты, которые могут быстро диффундировать через цитозоль[14]. Однако гидрофобные молекулы, такие как жирные кислоты или стеролы, могут переноситься в цитозоле с помощью специальных белков, которые транспортируют эти молекулы между мембранами[54][55]. В составе везикул в цитозоле транспортируются молекулы, захваченные при эндоцитозе или предназначенные для секреции[56]. Везикулы — это маленькие липидные мешочки, двигающиеся по цитоскелету при помощи моторных белков[57].
У прокариот в цитозоле протекает большинство метаболических процессов[58], как и у эукариот. Так, у млекопитающих около половины белков локализуются в цитозоле[59]. Показано, что у дрожжей почти все метаболические пути и метаболиты локализованы в цитозоле[60]. Среди метаболических процессов, которые у животных протекают в цитозоле, — синтез белка, пентозофосфатный путь, гликолиз и глюконеогенез[61]. У других организмов эти метаболические пути могут быть локализованы иначе. Например, у растений синтез жирных кислот[англ.] протекает в хлоропластах[62], а у апикомплексов — в апикопласте[англ.][63].
Примечания
[править | править код]- ↑ Goodsell D. S. Inside a living cell. (англ.) // Trends in biochemical sciences. — 1991. — Vol. 16, no. 6. — P. 203—206. — PMID 1891800.
- ↑ Lardy, H. A. 1965. On the direction of pyridine nucleotide oxidation-reduction reactions in gluconeogenesis and lipogenesis. In: Control of energy metabolism, edited by B. Chance, R. Estabrook, and J. R. Williamson. New York: Academic, 1965, p. 245, [1].
- ↑ 1 2 3 4 5 Clegg J. S. Properties and Metabolism of the Aqueous Cytoplasm and its Boundaries // The American Journal of Physiology. — 1984. — Vol. 246, no. 2 (Pt. 2). — P. 133—151. — PMID 6364846.
- ↑ 1 2 Cammack, Richard, Teresa Atwood, Campbell, Peter Scott, Parish, Howard I., Smith, Tony, Vella, Frank, Stirling, John. Oxford dictionary of biochemistry and molecular biology (англ.). — Oxford [Oxfordshire]: Oxford University Press, 2006. — ISBN 0-19-852917-1.
- ↑ 1 2 Lodish, Harvey F. Molecular cell biology (неопр.). — New York: Scientific American Books, 1999. — ISBN 0-7167-3136-3.
- ↑ Bowsher C. G., Tobin A. K. Compartmentation of metabolism within mitochondria and plastids. (англ.) // Journal of experimental botany. — 2001. — Vol. 52, no. 356. — P. 513—527. — PMID 11373301.
- ↑ Goodacre R., Vaidyanathan S., Dunn W. B., Harrigan G. G., Kell D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. (англ.) // Trends in biotechnology. — 2004. — Vol. 22, no. 5. — P. 245—252. — doi:10.1016/j.tibtech.2004.03.007. — PMID 15109811.
- ↑ Weckwerth W. Metabolomics in systems biology. (англ.) // Annual review of plant biology. — 2003. — Vol. 54. — P. 669—689. — doi:10.1146/annurev.arplant.54.031902.135014. — PMID 14503007.
- ↑ Reed J. L., Vo T. D., Schilling C. H., Palsson B. O. An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR). (англ.) // Genome biology. — 2003. — Vol. 4, no. 9. — P. 54. — doi:10.1186/gb-2003-4-9-r54. — PMID 12952533.
- ↑ Förster J., Famili I., Fu P., Palsson B., Nielsen J. Genome-scale reconstruction of the Saccharomyces cerevisiae metabolic network. (англ.) // Genome research. — 2003. — Vol. 13, no. 2. — P. 244—253. — doi:10.1101/gr.234503. — PMID 12566402.
- ↑ Luby-Phelps K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area. (англ.) // International review of cytology. — 2000. — Vol. 192. — P. 189—221. — PMID 10553280.
- ↑ Roos A., Boron W. F. Intracellular pH. (англ.) // Physiological reviews. — 1981. — Vol. 61, no. 2. — P. 296—434. — PMID 7012859.
- ↑ Bright G. R., Fisher G. W., Rogowska J., Taylor D. L. Fluorescence ratio imaging microscopy: temporal and spatial measurements of cytoplasmic pH. (англ.) // The Journal of cell biology. — 1987. — Vol. 104, no. 4. — P. 1019—1033. — PMID 3558476.
- ↑ 1 2 Verkman A. S. Solute and macromolecule diffusion in cellular aqueous compartments. (англ.) // Trends in biochemical sciences. — 2002. — Vol. 27, no. 1. — P. 27—33. — PMID 11796221.
- ↑ 1 2 Wiggins P. M. Role of water in some biological processes. (англ.) // Microbiological reviews. — 1990. — Vol. 54, no. 4. — P. 432—449. — PMID 2087221.
- ↑ Garlid K. D. The state of water in biological systems. (англ.) // International review of cytology. — 2000. — Vol. 192. — P. 281—302. — PMID 10553283.
- ↑ Chaplin M. Do we underestimate the importance of water in cell biology? (англ.) // Nature reviews. Molecular cell biology. — 2006. — Vol. 7, no. 11. — P. 861—866. — doi:10.1038/nrm2021. — PMID 16955076.
- ↑ Wiggins P. M. High and low density water and resting, active and transformed cells. (англ.) // Cell biology international. — 1996. — Vol. 20, no. 6. — P. 429—435. — doi:10.1006/cbir.1996.0054. — PMID 8963257.
- ↑ Persson E., Halle B. Cell water dynamics on multiple time scales. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2008. — Vol. 105, no. 17. — P. 6266—6271. — doi:10.1073/pnas.0709585105. — PMID 18436650.
- ↑ 1 2 3 Lang F. Mechanisms and significance of cell volume regulation. (англ.) // Journal of the American College of Nutrition. — 2007. — Vol. 26, no. 5 Suppl. — P. 613—623. — PMID 17921474.
- ↑ Sussich F., Skopec C., Brady J., Cesàro A. Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal? (англ.) // Carbohydrate research. — 2001. — Vol. 334, no. 3. — P. 165—176. — PMID 11513823.
- ↑ Crowe J. H., Carpenter J. F., Crowe L. M. The role of vitrification in anhydrobiosis. (англ.) // Annual review of physiology. — 1998. — Vol. 60. — P. 73—103. — doi:10.1146/annurev.physiol.60.1.73. — PMID 9558455.
- ↑ Berridge M. J. Elementary and global aspects of calcium signalling. (англ.) // The Journal of physiology. — 1997. — Vol. 499 ( Pt 2). — P. 291—306. — PMID 9080360.
- ↑ Kikkawa U., Kishimoto A., Nishizuka Y. The protein kinase C family: heterogeneity and its implications. (англ.) // Annual review of biochemistry. — 1989. — Vol. 58. — P. 31—44. — doi:10.1146/annurev.bi.58.070189.000335. — PMID 2549852.
- ↑ Orlov S. N., Hamet P. Intracellular monovalent ions as second messengers. (англ.) // The Journal of membrane biology. — 2006. — Vol. 210, no. 3. — P. 161—172. — doi:10.1007/s00232-006-0857-9. — PMID 16909338.
- ↑ 1 2 Ellis R. J. Macromolecular crowding: obvious but underappreciated. (англ.) // Trends in biochemical sciences. — 2001. — Vol. 26, no. 10. — P. 597—604. — PMID 11590012.
- ↑ Hudder A., Nathanson L., Deutscher M. P. Organization of mammalian cytoplasm. (англ.) // Molecular and cellular biology. — 2003. — Vol. 23, no. 24. — P. 9318—9326. — PMID 14645541.
- ↑ Heuser J. Whatever happened to the 'microtrabecular concept'? (англ.) // Biology of the cell. — 2002. — Vol. 94, no. 9. — P. 561—596. — PMID 12732437.
- ↑ Thanbichler M., Wang S. C., Shapiro L. The bacterial nucleoid: a highly organized and dynamic structure. (англ.) // Journal of cellular biochemistry. — 2005. — Vol. 96, no. 3. — P. 506—521. — doi:10.1002/jcb.20519. — PMID 15988757.
- ↑ Peters R. Introduction to nucleocytoplasmic transport: molecules and mechanisms. (англ.) // Methods in molecular biology (Clifton, N.J.). — 2006. — Vol. 322. — P. 235—258. — doi:10.1007/978-1-59745-000-3_17. — PMID 16739728.
- ↑ Zhou H. X., Rivas G., Minton A. P. Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences. (англ.) // Annual review of biophysics. — 2008. — Vol. 37. — P. 375—397. — doi:10.1146/annurev.biophys.37.032807.125817. — PMID 18573087.
- ↑ Norris V., den Blaauwen T., Cabin-Flaman A., Doi R. H., Harshey R., Janniere L., Jimenez-Sanchez A., Jin D. J., Levin P. A., Mileykovskaya E., Minsky A., Saier M. Jr., Skarstad K. Functional taxonomy of bacterial hyperstructures. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2007. — Vol. 71, no. 1. — P. 230—253. — doi:10.1128/MMBR.00035-06. — PMID 17347523.
- ↑ Wang S. Q., Wei C., Zhao G., Brochet D. X., Shen J., Song L. S., Wang W., Yang D., Cheng H. Imaging microdomain Ca2+ in muscle cells. (англ.) // Circulation research. — 2004. — Vol. 94, no. 8. — P. 1011—1022. — doi:10.1161/01.RES.0000125883.68447.A1. — PMID 15117829.
- ↑ Jaffe L. F. Classes and mechanisms of calcium waves. (англ.) // Cell calcium. — 1993. — Vol. 14, no. 10. — P. 736—745. — PMID 8131190.
- ↑ Aw T. Y. Intracellular compartmentation of organelles and gradients of low molecular weight species. (англ.) // International review of cytology. — 2000. — Vol. 192. — P. 223—253. — PMID 10553281.
- ↑ Weiss J. N., Korge P. The cytoplasm: no longer a well-mixed bag. (англ.) // Circulation research. — 2001. — Vol. 89, no. 2. — P. 108—110. — PMID 11463714.
- ↑ Srere P. A. Complexes of sequential metabolic enzymes. (англ.) // Annual review of biochemistry. — 1987. — Vol. 56. — P. 89—124. — doi:10.1146/annurev.bi.56.070187.000513. — PMID 2441660.
- ↑ Perham R. N. Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions. (англ.) // Annual review of biochemistry. — 2000. — Vol. 69. — P. 961—1004. — doi:10.1146/annurev.biochem.69.1.961. — PMID 10966480.
- ↑ Huang X., Holden H. M., Raushel F. M. Channeling of substrates and intermediates in enzyme-catalyzed reactions. (англ.) // Annual review of biochemistry. — 2001. — Vol. 70. — P. 149—180. — doi:10.1146/annurev.biochem.70.1.149. — PMID 11395405.
- ↑ Mowbray J., Moses V. The tentative identification in Escherichia coli of a multienzyme complex with glycolytic activity. (англ.) // European journal of biochemistry. — 1976. — Vol. 66, no. 1. — P. 25—36. — PMID 133800.
- ↑ Srivastava D. K., Bernhard S. A. Metabolite transfer via enzyme-enzyme complexes. (англ.) // Science (New York, N.Y.). — 1986. — Vol. 234, no. 4780. — P. 1081—1086. — PMID 3775377.
- ↑ Groll M., Clausen T. Molecular shredders: how proteasomes fulfill their role. (англ.) // Current opinion in structural biology. — 2003. — Vol. 13, no. 6. — P. 665—673. — PMID 14675543.
- ↑ Nandi D., Tahiliani P., Kumar A., Chandu D. The ubiquitin-proteasome system. (англ.) // Journal of biosciences. — 2006. — Vol. 31, no. 1. — P. 137—155. — PMID 16595883.
- ↑ Chowdhury C., Sinha S., Chun S., Yeates T. O., Bobik T. A. Diverse bacterial microcompartment organelles. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2014. — Vol. 78, no. 3. — P. 438—468. — doi:10.1128/MMBR.00009-14. — PMID 25184561.
- ↑ Yeates T. O., Kerfeld C. A., Heinhorst S., Cannon G. C., Shively J. M. Protein-based organelles in bacteria: carboxysomes and related microcompartments. (англ.) // Nature reviews. Microbiology. — 2008. — Vol. 6, no. 9. — P. 681—691. — doi:10.1038/nrmicro1913. — PMID 18679172.
- ↑ Badger M. R., Price G. D. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution. (англ.) // Journal of experimental botany. — 2003. — Vol. 54, no. 383. — P. 609—622. — PMID 12554704.
- ↑ Cate J. H. Construction of low-resolution x-ray crystallographic electron density maps of the ribosome. (англ.) // Methods (San Diego, Calif.). — 2001. — Vol. 25, no. 3. — P. 303—308. — doi:10.1006/meth.2001.1242. — PMID 11860284.
- ↑ Provance D. W. Jr., McDowall A., Marko M., Luby-Phelps K. Cytoarchitecture of size-excluding compartments in living cells. (англ.) // Journal of cell science. — 1993. — Vol. 106 ( Pt 2). — P. 565—577. — PMID 7980739.
- ↑ Luby-Phelps K., Castle P. E., Taylor D. L., Lanni F. Hindered diffusion of inert tracer particles in the cytoplasm of mouse 3T3 cells. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1987. — Vol. 84, no. 14. — P. 4910—4913. — PMID 3474634.
- ↑ Luby-Phelps K. Effect of cytoarchitecture on the transport and localization of protein synthetic machinery. (англ.) // Journal of cellular biochemistry. — 1993. — Vol. 52, no. 2. — P. 140—147. — doi:10.1002/jcb.240520205. — PMID 8366131.
- ↑ Kholodenko B. N. Four-dimensional organization of protein kinase signaling cascades: the roles of diffusion, endocytosis and molecular motors. (англ.) // The Journal of experimental biology. — 2003. — Vol. 206, no. Pt 12. — P. 2073—2082. — PMID 12756289.
- ↑ Pesaresi P., Schneider A., Kleine T., Leister D. Interorganellar communication. (англ.) // Current opinion in plant biology. — 2007. — Vol. 10, no. 6. — P. 600—606. — doi:10.1016/j.pbi.2007.07.007. — PMID 17719262.
- ↑ Winey M., Mamay C. L., O'Toole E. T., Mastronarde D. N., Giddings T. H. Jr., McDonald K. L., McIntosh J. R. Three-dimensional ultrastructural analysis of the Saccharomyces cerevisiae mitotic spindle. (англ.) // The Journal of cell biology. — 1995. — Vol. 129, no. 6. — P. 1601—1615. — PMID 7790357.
- ↑ Weisiger R. A. Cytosolic fatty acid binding proteins catalyze two distinct steps in intracellular transport of their ligands. (англ.) // Molecular and cellular biochemistry. — 2002. — Vol. 239, no. 1-2. — P. 35—43. — PMID 12479566.
- ↑ Maxfield F. R., Mondal M. Sterol and lipid trafficking in mammalian cells. (англ.) // Biochemical Society transactions. — 2006. — Vol. 34, no. Pt 3. — P. 335—339. — doi:10.1042/BST0340335. — PMID 16709155.
- ↑ Pelham H. R. The Croonian Lecture 1999. Intracellular membrane traffic: getting proteins sorted. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 1999. — Vol. 354, no. 1388. — P. 1471—1478. — doi:10.1098/rstb.1999.0491. — PMID 10515003.
- ↑ Kamal A., Goldstein L. S. Principles of cargo attachment to cytoplasmic motor proteins. (англ.) // Current opinion in cell biology. — 2002. — Vol. 14, no. 1. — P. 63—68. — PMID 11792546.
- ↑ Hoppert M., Mayer F. Principles of macromolecular organization and cell function in bacteria and archaea. (англ.) // Cell biochemistry and biophysics. — 1999. — Vol. 31, no. 3. — P. 247—284. — doi:10.1007/BF02738242. — PMID 10736750.
- ↑ Foster L. J., de Hoog C. L., Zhang Y., Zhang Y., Xie X., Mootha V. K., Mann M. A mammalian organelle map by protein correlation profiling. (англ.) // Cell. — 2006. — Vol. 125, no. 1. — P. 187—199. — doi:10.1016/j.cell.2006.03.022. — PMID 16615899.
- ↑ Herrgård M. J., Swainston N., Dobson P., Dunn W. B., Arga K. Y., Arvas M., Blüthgen N., Borger S., Costenoble R., Heinemann M., Hucka M., Le Nov N., Li P., Liebermeister W., Mo M. L., Oliveira A. P., Petranovic D., Pettifer S., Simeonidis E., Smallbone K., Spasić I., Weichart D., Brent R., Broomhead D. S., Westerhoff H. V., Kirdar B., Penttilä M., Klipp E., Palsson B., Sauer U., Oliver S. G., Mendes P., Nielsen J., Kell D. B. A consensus yeast metabolic network reconstruction obtained from a community approach to systems biology. (англ.) // Nature biotechnology. — 2008. — Vol. 26, no. 10. — P. 1155—1160. — doi:10.1038/nbt1492. — PMID 18846089.
- ↑ Stryer, Lubert, Berg, Jeremy Mark, Tymoczko, John L. Biochemistry (неопр.). — San Francisco: W.H. Freeman[англ.], 2002. — ISBN 0-7167-4684-0.
- ↑ Ohlrogge J. B., Kuhn D. N., Stumpf P. K. Subcellular localization of acyl carrier protein in leaf protoplasts of Spinacia oleracea. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1979. — Vol. 76, no. 3. — P. 1194—1198. — PMID 286305.
- ↑ Goodman C. D., McFadden G. I. Fatty acid biosynthesis as a drug target in apicomplexan parasites. (англ.) // Current drug targets. — 2007. — Vol. 8, no. 1. — P. 15—30. — PMID 17266528.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |