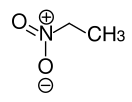
Нитроэтан
| Нитроэтан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
нитроэтан | ||
| Хим. формула | C2H5NO2 | ||
| Рац. формула | C2H5NO2 | ||
| Физические свойства | |||
| Молярная масса | 75,067 г/моль | ||
| Плотность | 1,05 ± 0,01 г/см³[1] | ||
| Энергия ионизации | 10,88 ± 0,01 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −90 °C | ||
| • кипения | 114 °C | ||
| • вспышки | 82 ± 1 ℉[1] | ||
| Пределы взрываемости | 3,4 ± 0,1 об.%[1] | ||
| Давление пара | 21 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в вода | 4,7 г/100 мл | ||
| Структура | |||
| Дипольный момент | 1,1E−29 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 79-24-3 | ||
| PubChem | 6587 | ||
| Рег. номер EINECS | 201-188-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | KI5600000 | ||
| ChEBI | 16268 | ||
| ChemSpider | 6338 | ||
| Безопасность | |||
| Фразы риска (R) | R5, R10, R22 | ||
| Фразы безопасности (S) | S41 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Нитроэтан — органическое вещество, маслянистая жидкость.
Получение
[править | править код]В промышленности нитроэтан получают нитрованием пропана азотной кислотой в газовой фазе при атмосферном давлении и температуре 390—480 ℃. Благодаря пиролизу углеводородных радикалов происходит образование нитроалканов с числом атомов меньшим, чем у исходного пропана. Полученная смесь содержит 1-нитропропан, 2-нитропропан, нитроэтан и нитрометан. Кроме того образуются продукты окисления углеводорода и нитроалканов. Разделение смеси осуществляется фракционной перегонкой.
В лабораторных условиях нитроэтан можно получать реакцией бромэтана с нитритом натрия в диметилформамиде[3]
Применение
[править | править код]Нитроэтан используется в органическом синтезе и в качестве растворителя.
Правовой статус
[править | править код]Постановлением правительства Российской Федерации от 9 апреля 2015 года № 328 внесён в перечень наркотических средств, психотропных веществ и их прекурсоров в концентрации 40 процентов или более[4].
Примечания
[править | править код]- ↑ 1 2 3 4 5 http://www.cdc.gov/niosh/npg/npgd0453.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Ким А. М. Органическая химия: Учеб. пособие. — 3-е изд., испр. и доп. — Новосибирск: Сиб. унив. изд-во, 2002. — С. 818. — 2400 экз. — ISBN 5-94087-036-8.
- ↑ О внесении изменений в некоторые акты Правительства Российской Федерации в связи с совершенствованием контроля за оборотом прекурсоров наркотических средств и психотропных веществ, Постановление Правительства РФ от 09 апреля 2015 года №328. docs.cntd.ru. Дата обращения: 11 мая 2019. Архивировано 11 мая 2019 года.
Литература
[править | править код]- Новиков С. С., Швехгеймер Г. А., Севостьянова В. В., Шляпочников В. В. Химия алифатических и алициклических нитросоединений. — М.: Химия, 1974. — 416 с. — 2200 экз.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.